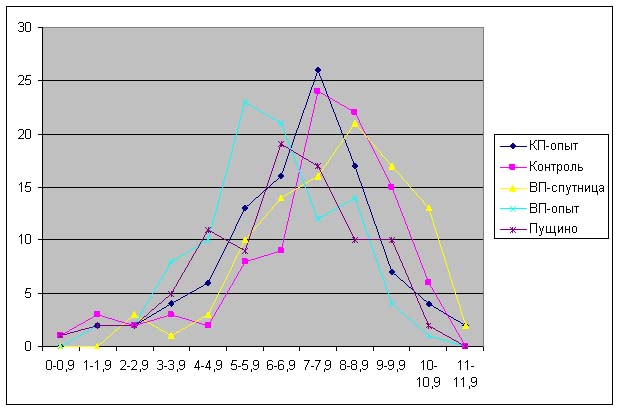
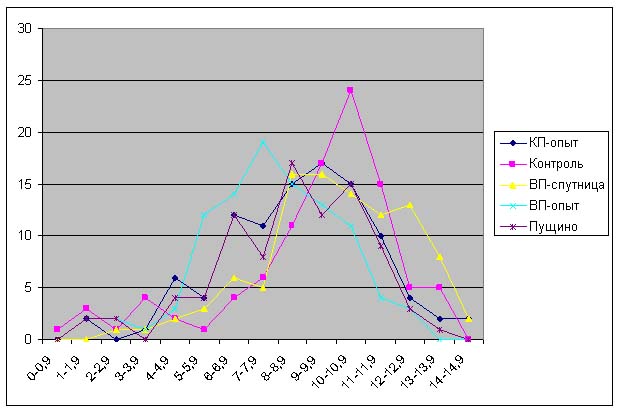
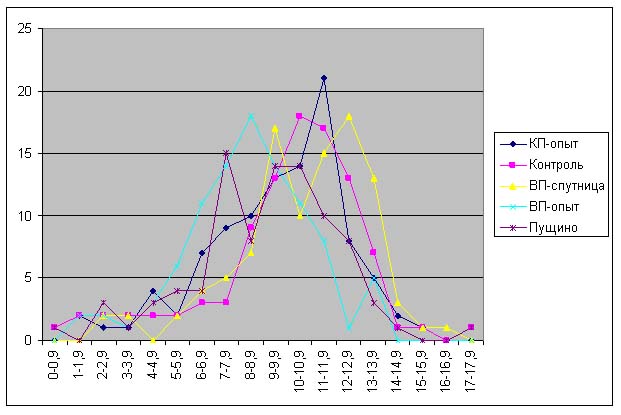
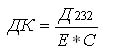|
3. Исследование
продуктов перекисного окисления липидов в хлоропластах листьев проростков
гороха.
Многочисленные исследования последних десятилетий
показали, что независимо от природы воздействия, ответ растения на него
развивается по некоторой общей схеме, что позволяет говорить о существовании
неспецифической стрессовой реакции на воздействия извне. Таким универсальным
звеном в реакции растительного организма на действие самых разнообразных
факторов может быть некоторое стереотипное изменение внутренней среды клетки, на
роль которого многие исследователи выдвигают окислительный стресс. Большое
внимание в последнее время уделяется механизмам ответа живых систем на слабые
внешние воздействия. Предполагается, что действие факторов, по силе не выходящих
за зону толерантности организмов, формируется не вследствие прямого
повреждающего эффекта стрессора, а в результате разбалансирования процессов
повреждения и восстановления клеточных структур. В связи с этим исследование
слабых воздействий может способствовать выявлению механизмов тонкой регулировки
внутренних процессов, происходящих при внешних возмущениях. В клетке постоянно
протекают окислительно-восстановительные процессы, способные приводить к
появлению активных форм кислорода (АФК). Наиболее эффективно этот процесс идет
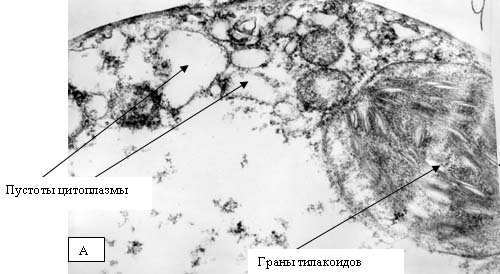
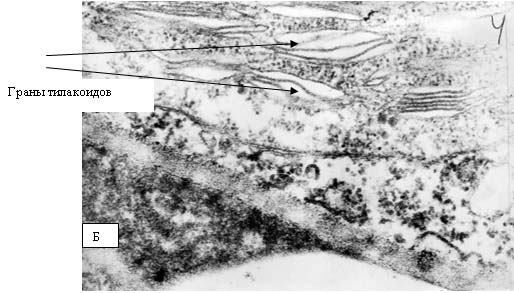
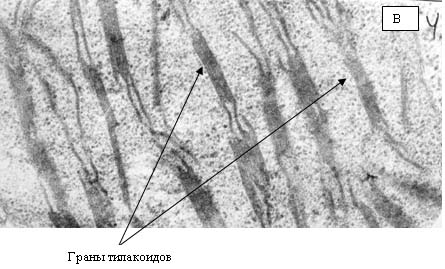
на сопрягающих мембранах митохондрий и хлоропластов. Хлоропласты являются теми
структурами растительной клетки, в которых образование АФК происходит с
наибольшей эффективностью. В силу своей высокой активности, АФК способны
вызывать повреждение важнейших биополимеров: нуклеиновых кислот, белков, липидов
и углеводов. Поэтому неотъемлемой чертой всех аэробных организмов является
неферментативное окисление биологических молекул по радикальному механизму с
участием кислорода. АФК генерируют органические гидропероксиды
ROOH, подобные по структуре пероксиду водорода и также
химически активные. При последующем метаболизме они переходят в спирты,
альдегиды, эпоксиды и т.д. Этот процесс называется перекисным окислением, а
совокупность этих реакций – окислительными модификациями молекул.Однако наиболее
активно свободнорадикальное окисление идет при атаке инициирующим радикалом
диаллильного атома углерода, в связи с этим в реакцию наиболее активно вступают
полиненасыщенные жирные кислоты липидов мембран. В растениях окислению
подвергаются преимущественно линолевая, линоленовая и олеиновая кислоты.
Первичными продуктами перекисного окисления липидов являются пентадиенильные
радикалы, образующие диеновые конъюгаты и гидроперекиси жирных кислот.
Дальнейшее их окисление и распад приводит к образованию широкого спектра
конечных продуктов: альдегидных и спиртовых производных с укороченной цепью, в
частности 4-гидрокси-2-ноненаль, низкомолекулярные продукты (этан, пентан),
малоновый диальдегид, эпоксиды. Выход окислительных процессов из-под контроля
может быть губителен для клетки, однако в то же время существует представление
об АФК, как о нормальных и даже необходимых метаболитах аэробной клетки. В общем
случае ПОЛ является универсальным модификатором свойств биологических мембран,
важным физиологическим регулятором их структуры и функций, фактором,
устанавливающим и поддерживающим стационарное функционирование ферментов,
каналообразователей, рецепторов.
Методы
исследования
Приготовление суспензии хлоропластов
Суспензию готовили методом дифференциального
центрифугирования, основанном на разности коэффициентов седиментации разных
органелл клетки (Arnon et al.,
1956).
Навеску листьев гороха 1
г растирали с 7 мл среды выделения (10,5 мл 1 М NaCl
+ 6 мл 0,1 М трис-HCl буфер + 14,5 мл воды) в
фарфоровой чашке во льду. Разливали в центрифужные
пробирки и центрифугировали 6 мин при 4 тыс. об./мин при охлаждении (4˚С).
Супернатант сливали, осадок (хлоропласты) ресуспензировали с 1,5-2 мл
0,035 М NaCl.
Определение содержания диеновых конъюгатов
Степень диеновой конъюгации ненасыщенных высших жирных
кислот определяли по методике И.Д. Стальной (1977).
Для определения диеновых конъюгатов 0,5 мл суспензии
растворяли в 4,5 мл смеси гептан: изопропиловый спирт в соотношении 1:1 и
центрифугировали 10 мин при 4 тыс. об/мин. К надосадочной жидкости добавляли 0,1
объема воды для разделения фаз. К 0,5 мл верхней гептановой фазы добавляли 2,5
мл этанола и спектрофотометрировали против контроля (гептан : спирт в
соотношении 1 : 5). В ходе ПОЛ на стадии образования свободных радикалов в
молекулах НЖК возникает система сопряженных двойных связей, что сопровождается
появлением нового максимума в спектре поглощения при 232 нм.
Расчет ДК производили по формуле:
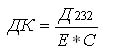
где Д232 - оптическая плотность, Е
- коэффициент молярной экстинкции, 2,1.10-6 моль-1.
см-1,
С - концентрация липидов, мг / мл.
Диеновые конъюгаты выражали в мкМоль ДК / мг липидов.
Определение липидов
Содержание липидов проводили спектрофотометрически по
реакции с фосфорно-ванилиновой смесью.
Обычно продукты перекисного окисления измеряют в
хлоропластах проростков (в случае, когда речь идет о растениях), подверженных
какому-либо воздействию, например, радиации. По этому поводу существует большое
количество работ. Однако, в проростках, выращенных из семян, подвергшихся
какому-либо воздействию, продукты перекисного окисления не меряют. Особых
оснований полагать, что уровень продуктов перекисного окисления каким либо
образом поменяется в таких проростках, нет. Тем не менее
окислительно-восстановительные процессы протекают на мембранных структурах, в
том числе на мембранах хлоропластов, протекают постоянно за счет образования
активных форм кислорода (АФК). Результатом увеличения продукции АФК, как
правило, является смещение прооксидантно-антиоксидантного равновесия в сторону
интенсификации окислительных процессов, об активности протекания которых можно
судить по накоплению продуктов ПОЛ. В некоторых работах ПОЛ рассматривается как
маркер неспецифического ответа организма на воздействие извне. ПОЛ – цепной
процесс свободнорадикального окисления – приводит к образованию пентадиенильных
радикалов, которые образуют диеновые и триеновые конъюгаты и гидроперекиси
жирных кислот. Конечными продуктами ПОЛ являются альдегидные и спиртовые
производные гидроперекисей, низкомолекулярные продукты (этан, пентан), эпоксиды,
малоновый диальдегид (МДА).
В нашей работе мы измеряли диеновые конъюгаты (первичные
продукты ПОЛ) и основания Шиффа, которые образуются на более поздних стадиях.
Разумеется, для того чтобы определить окислительно- восстановительный статус
клетки, нужно промерить большее количество продуктов ПОЛ, а также ферменты
антиоксидантной системы, которые поддерживают окислительно – восстановительный
баланс. Однако, задачей данного исследования было посмотреть будет ли
проявляться различие нахождение семян в разных условиях на продукты ПОЛ,
образующихся в проростках из таких семян.
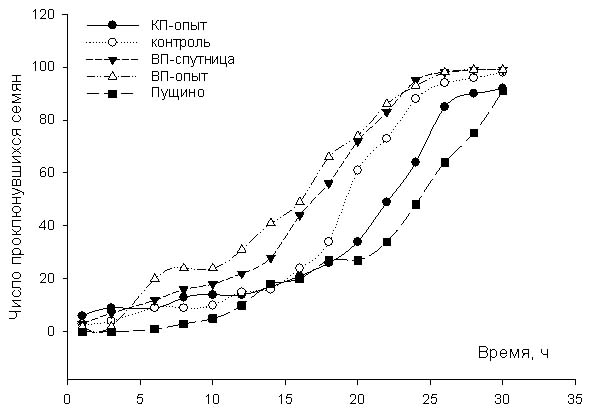
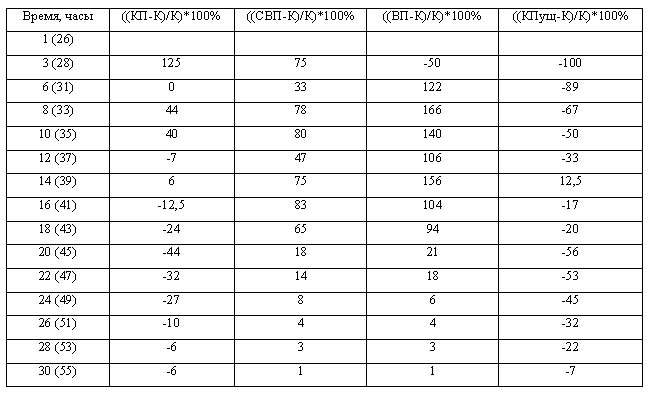
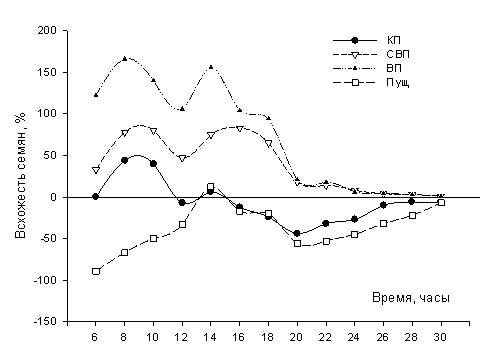
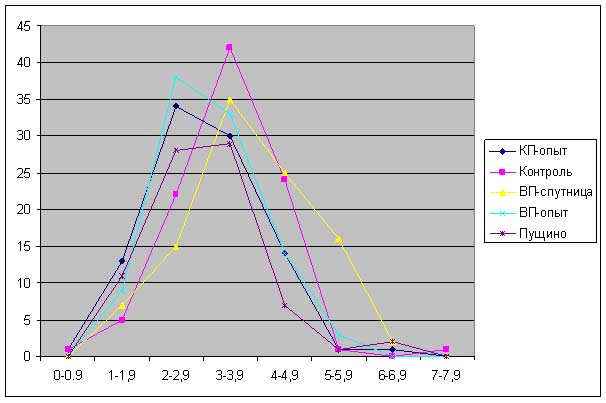
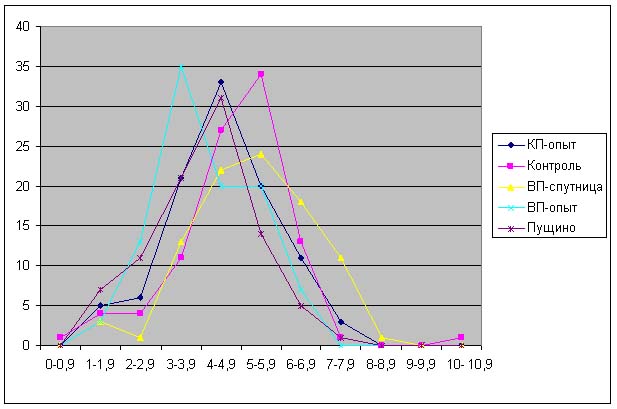
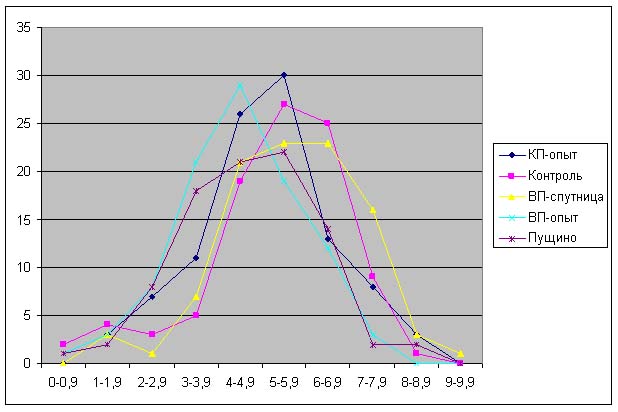
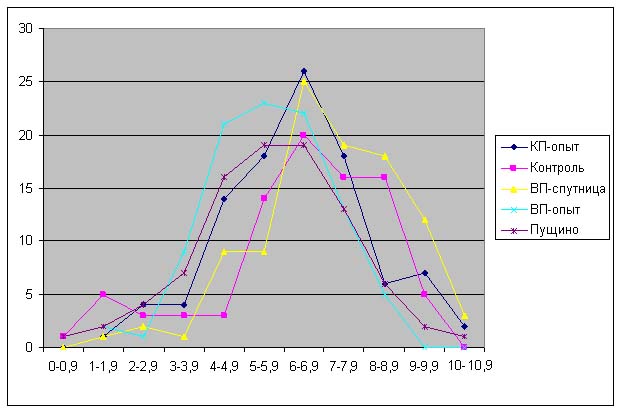
Результаты.
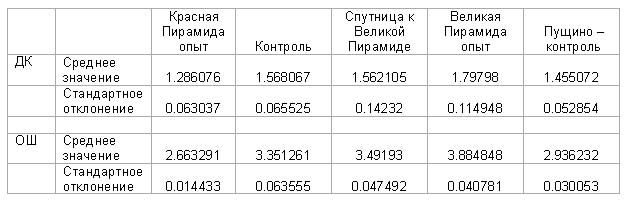
Красная пирамида - разница по
отношению к контролю:
ДК: -18% ± 7%
ОШ: -21% ± 2%
Великая Пирамида – разница по
отношению к контролю
ДК: 14%±4%
ОШ: 16%±3%
Спутница к Великой пирамиде –
разница по отношению к контролю:
ДК: 3%±12%
ОШ: 4%±3%
Контроль в Пущино - разница по
отношению к контролю:
ДК: -12% ± 8%
ОШ: -9%±1.5%
Великая пирамида - разница по
отношению к Пирамиде - спутнице:
ДК: +15% ± 16%
ОШ: +11%± 3%
Красная пирамида по отношению к
контролю в Пущино:
ДК: +7% ± 13%
ОШ: -9% ± 1.5%
Великая пирамида по отношению к
контролю в Пущино:
ДК: +24% ± 11%
ОШ: +32%±3%
Спутница к Великой пирамиде по
отношению к контролю в Пущино:
ДК: +7% ± 13%
ОШ: +20%+3%
|
 |